






研究の背景と概要
すべての植物は、光合成において水を酸化分解する触媒として葉緑体の中で酸化マンガンをつかっています。FSLは酸化マンガンの結晶構造を制御することで発現する種々の機能性に関する研究を長年続けて来ました。一連の研究から得られた成果は、国内外の学会や査読付きの学術誌において公表されています。このたび、それら研究成果のひとつとして、室温の水中から極低濃度のトリチウムを選択的に分離・回収する技術を開発するに至りました。
トリチウムは大気や水中に水分子の同位体異性体(HTO)として存在します。HTOは、物理化学的性質が通常の水分子(H2O)と似ているために分離が容易ではありません。これまで、室温下でHTOを水や空気中から選択的に分離回収する技術は全く存在しませんでした。さらに、トリチウム濃度が10000 Bq/mL以下の超低濃度の場合には、トリチウムを分離することが不可能であるとさえ考えられてきました。
弊社の技術をもちいた実験結果の例として、トリチウム濃度が4000 Bq/mLの試験水から分離効率2.66×106 Bq/m2hでトリチウムを室温で分離できることを実証しました。この分離効率は、酸化マンガンを含む反応膜の単位面積・単位時間あたりに水中から分離できるトリチウムの量(Bq)を示しています。
同分離効率の値が実際にどのくらいの性能に相当するのか?わかりやすく説明するために、福島原発事故現場に敷設されたタンク群に保管されている莫大なトリチウム汚染水の全量に対する適用を想定して効果を試算してみました。その結果、同反応膜(面積1m2)を1万枚(総面積10000 m2)使えば、約6年間で汚染水全量に含まれるトリチウムを全量分離回収できるという、極めて期待がもてる性能が試算されました。
また、同分離効率は反応膜を適切に設計することで増加することがわかっています。このため、さらに短期間でトリチウムを効率よく分離できる浄水プラントが実現します。処理に必要な期間は、浄水プラントの規模にしたがって必要な処理時間は短縮できます。したがって、今後、処理対象水の量と質(他核種の濃度・油や界面活性剤の濃度など)、および期限など設計に必要な情報が充分に開示されれば、最適なコストパフォーマンスを考慮した浄水プラントの設計・施工が可能になります。
研究の経緯
ここで、「酸化マンガンの結晶構造を化学的に制御するトリチウムの分離」とは、具体的にどのような技術なのか、研究の経緯を追いながら述べてみたいと思います。記述が少しだけ専門的で長くなりますので、福島原発事故汚染水に対する適用について主に知りたい方は、本稿の下段の図4〜6で浄水処理プラントを提案しています、そちらからご覧下さい。
ガラスや水銀などは、物質を構成する原子のならび方がランダムであることからアモルファスという特殊な物質であることが知られています。しかしながら、酸化マンガンなどの一般的な物質のほとんどは、物質を構成する原子のならび方に規則性が存在し、その規則性には物質に応じていくつかの種類が存在します。この原子がならぶ規則性の違いが結晶構造の違いとして分類され、空間群という指標で識別されます。今回、トリチウムの分離に使われた酸化マンガンは、空間群が Fd3mの結晶構造にあたります。この結晶構造を有する酸化マンガンは、スピネル型の結晶構造をもつ酸化マンガンとして知られており、1970年代頃から世界中の多くの固体物理や電気化学の分野の研究者によって物性と機能性が報告されてきた物質です。
特に、同酸化マンガンの結晶内におけるリチウムイオンと水素イオンの交換性と拡散性に関しては、電池としての応用に対する期待もあって数えきれないほどの報告が存在します。高名なJ. B. Goodenough博士らもリチウムイオンの挿入によって結晶の膨らみや縮みを表す指標である格子定数が大きく変化し、電池材料としての性能に影響することを報告しています。私共も2003年に水素イオン化した同酸化マンガンを乾燥処理することで、結晶内の水素イオンが水(H2O)として表面から蒸散することを報告しています[1]。これが今回、同酸化マンガンに取り込まれたトリチウムイオンが水分子(HTO)として蒸散することに気づく手がかりになりました。
図1に、同酸化マンガン表面の透過型電子顕微鏡写真を載せました。図中、長さの縮尺を表すバーは 25 Å (オングストローム=10-10 m)の長さを示し、同酸化マンガン1粒子の表面を構成する原子群の観察に適した高解像度であることがわかります。

図1 スピネル型酸化マンガン表面の透過型電子顕微鏡写真 ref. [1]
酸素とマンガンの原子が規則的に配列して表面を構成している。同表面の無数の細孔を通じて、水素イオン、重水素イオン、トリチウムイオン、リチウムイオンが結晶内に取り込まれる。結晶の格子定数は、主にリチウムイオンの含有量に応じて増減し、トリチウムの吸着/脱着には、それぞれ適した格子定数の範囲が存在する。
また、私共は、同酸化マンガンの結晶構造に特別な原子間距離を有した酸素ペアがネットワークを構成していることを報告しました[2]。同ネットワークの存在が結晶を構成する酸素イオンに強い水素結合[3](弱い共有結合ともいわれる)によって水素イオンが吸脱着する原因になっています。一般に、結晶内で水素イオンを束縛する結合力が強すぎると水素イオンの吸着が一過性になり、脱着させることが困難になってしまいます。したがって、結晶を構成する酸素イオンが強い水素結合で水素イオンと結合する物性は、水素イオンとの吸着反応と脱着反応を両立させるために不可欠といえます。また、同ネットワークを通じて結晶内の局所におけるイベントである水素イオンとの結合が情報として1粒子内にかぎらず、粒界を通じて全粒子に伝わる効果が考察できました。
2012年当初、本研究における課題は、そもそもトリチウムイオンが水素イオンや重水素イオンと同様にスピネル型の酸化マンガンの結晶に吸着して取り込まれるかどうか?を確認することでした。幸いにも京都大学放射性同位元素総合センターの協力が得られ、水素イオン化した酸化マンガンの粉末をトリチウムを含む試験水に懸濁させた際のトリチウム濃度の変化を調べる機会を得ました。同センターの放射性物質をあつかう施設において、RI管理区域内の実験室および測定装置として液体シンチレーションカウンターを利用することができました。
結果は、水素イオン化した酸化マンガンを懸濁した後、15分程度でトリチウム濃度が初期濃度の30%ほど減少することがわかりました。しかし、40分も経つと初期濃度ちかくに戻ってしまうという実用性に乏しい一時的な吸着反応でした。仮に、同酸化マンガン表面におけるトリチウムイオンの吸着が水素イオンとのイオン交換によって生じたのであれば、トリチウム濃度が変動した原因は酸化マンガンの表面が含有する水素イオン量の不足ではないかと考えました[4]。
上記の水素イオン不足を解消するために、課題は如何に粉末状の酸化マンガンに対して水素イオンを供給しながらトリチウムとのイオン交換を継続させるか?でした。まず、酸化マンガン粉末を市販の導電性塗料と混合して厚み1mm程度の膜状に成形し、これを焼成することで固化しました。固化した膜の正面をトリチウムを含む試験水に接触させ、背面の膜表面には希酸を配置・接触させる反応系を設計・製作し、実験してみました。
この実験に供した反応系は、焼成によって膜表面に生じる細孔を通じて酸化マンガン粉末に希酸由来の水素イオンを供給するアイデアでしたが、結果的に、時間の経過とともに同膜の細孔を通じて希酸と試験水が混じり合うことが判明し、さらなる改良が必要になりました。
この頃までの状況は、 https://vimeo.com/120439648 に公開の動画で観ることができます。
改良策として、希酸との接触面には水素イオン導伝材であるナフィオン@(デュポン社の登録商標)を塗布・乾燥して反応膜を補強し、さらに希酸の量も必要最少限ですむ反応系を設計・製作しました。この新しい反応系を用いて試験水に適用した結果、粉末状の酸化マンガンを用いた際にみられた一時的なトリチウム濃度の低下は発生せずに、継続的なトリチウム濃度の低下が観察されました。さらに吸着トリチウムを極少量のキャッチャー物質(例えば、H2Oやシリカゲル)に回収する仕組みを追加考案し、同仕組みを組み入れた反応系によってトリチウムの継続的な分離と回収が実現しました。
多くの改良を施した同反応系によって得られた実験結果の一例として、トリチウム初期濃度3863.8 Bq/mLの試験水に適用した実験では、実験開始から120時間が経過してもトリチウム濃度は低下しつづけ、同時に試験水中の濃度低下量に相当する全量の約88.8%がキャッチャーに回収できました[6]。
しかしながら、同実験から新たな課題も見つかりました。一つ目は、トリチウムの吸着が活発に生じるように試験水のpHを弱酸性からアルカリ性に調整するためのアルカリ試薬を添加した瞬間、反応膜からマンガンイオンが溶出してスラッジが試験水中に発生することでした。本実験は、試験水の容量が200mL程度の小規模な実験なので発生する沈殿物のスラッジも少量なのですが、規模が大きい実際の水処理プラントで同様に発生すると処理コスト的にも大きな問題になってしまいます。二つ目は、反応系を長時間運転した際にトリチウム濃度の減少速度が低下することでした。
これらの新たな課題の対策として、試験水にアルカリ試薬を添加する操作に先立って、試験水に一定割合で極少量の塩化リチウムを添加してみました。その効果は絶大で、試験水中のスラッジ発生が完全に抑制されることがわかりました [7]。さらに、同添加はトリチウム濃度の減少速度を保つことにも有効でした。これらの知見は、同反応系を運転する際のメンテナンスにおける重要なポイントであり、反応膜の高寿命化と性能維持に寄与することになりました。
トリチウム分離・回収の原理
スピネル型酸化マンガンを含有する反応膜を用いてトリチウムを分離・回収を分離・回収する原理と手順を図2で説明します。同図は反応膜を試験水側から見た正面図であり、背面に希酸を配置することで同反応膜に水素イオンを供給しています。図中、反応膜に含まれる酸化マンガン粒子の格子間隔が気中と水中では異なることをグリットのサイズの違いで表現しています。すなわち、水中ではトリチウムイオンの吸着に適した格子間隔をもつ酸化マンガン粒子が機能し、気中ではトリチウムイオンの脱着に適した格子間隔をもつ酸化マンガン粒子が機能することによって、水中と気中でそれぞれトリチウムの吸着と脱着が生じていると考えられます。
同考察は、粉末の同酸化マンガンを試験水に適用した際に、酸化マンガンの結晶の格子定数(a)が8.037<a<8.040 Åの範囲にある際に高いトリチウムの吸着能が実験で確認され、また格子定数が8.036Åと値が低く結晶が縮んだ状態ではトリチウムの吸着がほとんど生じないという実験結果[5]に基づきます。
図2の下に記述した(1)〜(3)の手順にしたがってトリチウムの分離・回収が進みます。また、反応容器内において反応膜が気液と接している長さ(蒸散長)を適切に設計することで、気中に水の同位体異性体(HTO)が蒸散することが促されます。反応系の生成物である(HTO)を反応膜から効率的に蒸散させることによって、水中からのトリチウムの吸着速度が向上します[8]。
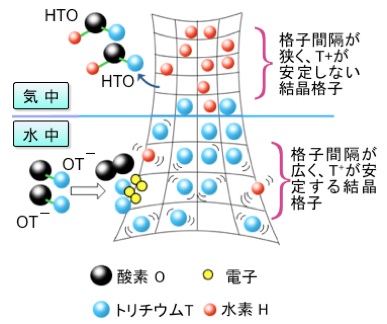
図2 水中からトリチウムが分離・回収される原理と手順
-
-
-
(1)水中で、トリチウムを含む水酸化物イオン(OT-)が反応膜の表面に吸着。
-
(2)吸着OT-が酸化マンガン表面で分解、トリチウムイオン(T+) として酸化マンガンの結晶に取り込まれる。この結果、水中のトリチウム濃度が減少する。
-
(3)気中で、反応膜の表面からトリチウムイオン(T+)がトリチウムを含む水分子(HTO)として反応容器内部のヘッドスペースに蒸散する。この蒸散 HTOを反応容器のヘッドスペースに導入した気流にのせてキャッチャー容器に回収する。
-
-
-
極低濃度トリチウムの分離・回収を実現したスキーム
本トリチウムの分離現象は、図3の右下に示した様に、見かけ上は反応膜の表面における酸(H+)とアルカリ(OT-)の中和反応に基づく単純な化学反応とみなせます。しかしながら、実験結果においてトリチウムに対する高い選択性が生じていることを考慮すると単純な中和反応では説明できません。同分離現象の本質は、水分子の同位体異性体(HTO)が水中のブラウン運動衝突によって自然解離することで生じる水酸化物イオンの同位体異性体(OT-)が、酸化マンガン表面で選択的に酸化分解される複雑な触媒反応であると考えられます。
また、通常の水分子(H2O)に比べてHTO分子は、その分子構造上の非対称性によって解離しやすいのかもしれません。したがって、トリチウムイオン(T+)の方が水素イオン(H+)よりも取り込まれやすい酸化マンガンの表面においては、OT-の方がOH-よりも優先的に反応すると考えられます。結果として、水中濃度が極低濃度であってもトリチウムに対する選択的な分離が生じていると考察しています。
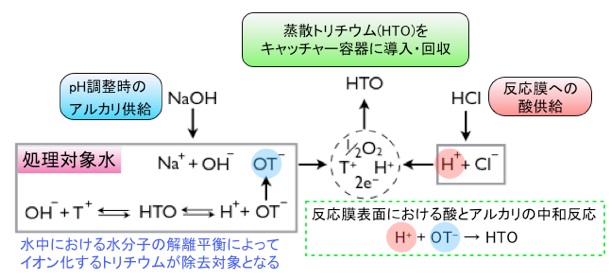
図3 トリチウムの分離・回収スキーム
References
-
[1] H. Koyanaka, O. Matsubaya, Y. Koyanaka, and N. Hatta, Quantitative correlation between Li absorption and H content in Manganese Oxide Spinel λ-MnO2, J. Electroanalytical Chemistry, 559, Nov p.77-81, (2003)
-
[2] E. Libowitzky, Correlation of O-H Stretching Frequencies and O-H⋅⋅⋅O Hydrogen Bond Lengths in Minerals, Monatshefte fur Chemie 130, 1047-1059, (1999)
-
[3] H. Koyanaka, Y. Ueda, K. Takeuchi, and A. I. Kolesnikov, Effect of crystal structure of manganese dioxide on response for electrolyte of a hydrogen sensor operative at room temperature, Sensors & Actuators: B, 183, pp. 641-647, (2013)
-
[4] H. Koyanaka and H. Miyatake, Extracting tritium from water using a protonic manganese oxide spinel, Separation Science and Technology, 50, 14, 2142-2146, (2015)
-
[5] 古屋仲秀樹, 福谷哲, 宮武秀男, プロトン含有酸化マンガンのトリチウム吸脱着能に対するスピネル型結晶格子定数の影響, 電気化学会第86回大会, 予稿集 2H07, (2019)
-
[6] H. Koyanaka and S. Fukutani, Tritium separation from parts-per-trillion-level water by a membrane with protonated manganese dioxide, J. Radioanalytical and Nuclear Chemistry, 318, 175-182, (2018)
-
[7] H. Koyanaka, S. Fukutani, and H. Miyatake, Tritium separation from heavy water using a membrane containing deuterated manganese dioxide, J. Radioanalytical and Nuclear Chemistry, 322, 1889-1895, (2019)
-
[8] 古屋仲秀樹, 酸化マンガン触媒の水素イオン同位体効果による水中からのトリチウムの分離, 第122回触媒討論会 予稿集1J20, (2018)
1Fでの実用化に向けて
図4に、本分離技術を用いて水中のトリチウムを分離する際に、処理対象水のトリチウム初期濃度が分離効率に与える影響を示しました。同図においては、横軸のトリチウム初期濃度が左下に点線の円で示した様な極低濃度の場合においても縦軸の分離効率が105〜106 Bq/m2hであり、本分離技術が実用的な効率を保っていることがわかります。
また、1Fでタンク群に保管されている処理対象水は、図中に記載した赤い両矢印の濃度領域のトリチウムを含有していることが公表されています。
上述した原理によって、極低濃度のトリチウムの分離を得意とする本分離技術は、赤い両矢印で示した濃度領域の1Fで保管されているトリチウムを分離・回収できる能力を有することが明らかです。本分離技術をプラント化することによって、1Fの処理対象水を飲料水レベルにまで浄水することが期待できます。
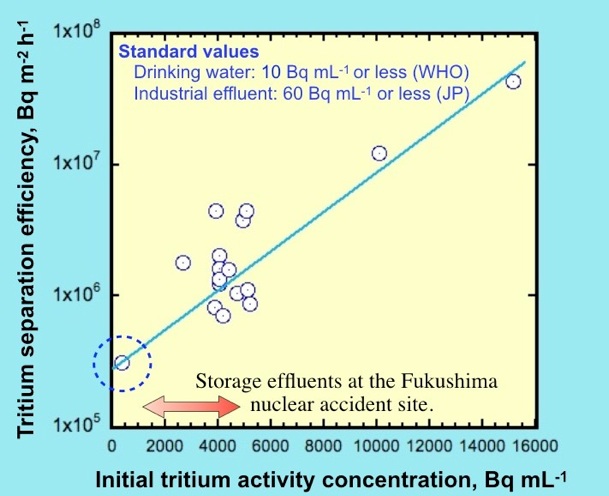
図 4 処理対象水のトリチウム初期濃度が分離効率に与える影響
本トリチウムの分離・回収技術を1Fの処理対象水に適用する場合の浄水プラントに関して、想定処理スペックを以下に箇条書きで列挙しました。また、図5には同スペックを実現するための浄水プラントの構想図、および図6に処理濃度に応じて直列多段に配置した処理タンクによる段階的な分離システムの概要を載せました。
1Fトリチウム浄水プラントの想定処理スペック
-
 トリチウム濃度の減少率:1/10000
トリチウム濃度の減少率:1/10000
処理対象水のトリチウム濃度(2000〜10000 Bq/mL)を1 Bq/mL 以下する
-
 処理対象水の減容率:1/100000
処理対象水の減容率:1/100000
処理対象水100トン単位から分離して回収容器の水1Kg中に導入して実現
-
 処理速度: 1000 トン/日
処理速度: 1000 トン/日
直列配置の処理ラインを並列設置して実現
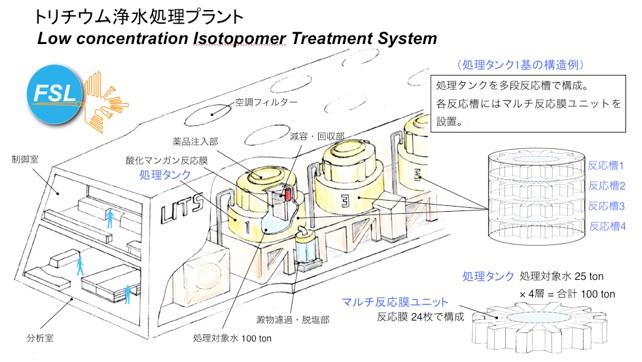
図 5 トリチウム浄水プラントの構想図
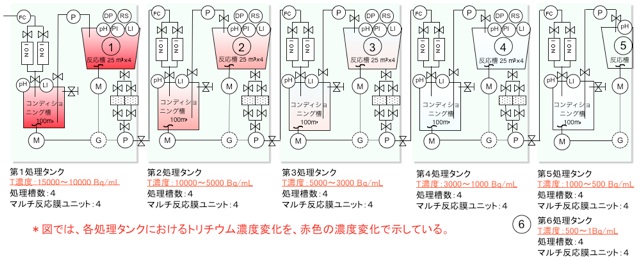
図 6 直列多段に配置した処理タンクによる段階的な分離システム
直列多段に処理タンクを配置して段階的にトリチウムの濃度低下を実現。 トリチウム濃度が高い処理水から順に処理する。最終的にトリチウム濃度を1 Bq/mL以下にする。各処理タンクから回収されたトリチウムは、濃度に応じて保管・再処理工程にまわす。また、予め、トリチウム以外の残留核種を除去するために、浮選法(少量の薬品添加でコロイドを形成する核種を気泡に吸着させて浮上させる、高効率かつ安価な除去手法)を用いて予備処理を実施する。
酸化マンガン法の特徴
-
 極低濃度域(数百〜1万Bq/mL)*のトリチウムを室温下で分離・回収
極低濃度域(数百〜1万Bq/mL)*のトリチウムを室温下で分離・回収
*1Fタンク群に保管されているトリチウム濃度に相当する
-
 高い減容率:少量の軽水に回収して、処理対象水を1/10万に減容
高い減容率:少量の軽水に回収して、処理対象水を1/10万に減容 -
 大量合成方法が確立されている、安価な酸化マンガンを利用
大量合成方法が確立されている、安価な酸化マンガンを利用 -
 反応膜を浸して保守するだけの、安価でシンプルなシステム構成
反応膜を浸して保守するだけの、安価でシンプルなシステム構成 -
 同一構造の反応タンクを利用するため、処理プラントの保守が容易
同一構造の反応タンクを利用するため、処理プラントの保守が容易


代表的なクリーンエネルギーのひとつである水素は、主にメタン(天然ガス)を水蒸気改質することで製造されています。この水蒸気改質プラントにおける水素製造効率を、FSLでは触媒を使って5%向上させ、無駄なく天然ガスを水素に変換する技術を開発しています。

水素を製造するプラントや水素を燃料としてつかう際には、高濃度(1〜99vol.%)の水素濃度を簡易に計測できるセンサーが必要になります。FSLでは、酸化マンガン電解質を用いた室温作動型水素濃度センサーの開発に取り組んでいます。

Copyright (c) 2018 FSL Ltd. All rights reserved
